Research
感染症研究の課題
近年の新型コロナウイルス感染症の経験を通じて、今後解決しなければいけない重要な課題が見えてきました。例えば、同じ病原体(細菌、真菌、寄生虫、ウイルスなど)に何度も感染する人もいれば、全く感染しない人もいます。また、病原体に感染した時に、重症化(なかには死亡)する人もいれば、無症状の人もいます(下図)。さらにワクチン接種後に、副作用がほとんど無い人もいれば、辛い副作用に悩まされる人もいます。ワクチン接種によって誘導される抗体価も、人によって高かったり低かったり様々です。このような現象は、よく「個人差」とか「個体差」、「体質の違い」という言葉で表現されますが、「個人差」、「個体差」、「体質の違い」とは一体何でしょうか? 何によって決まるのでしょうか?
.png)
腸内細菌が今ホットです!
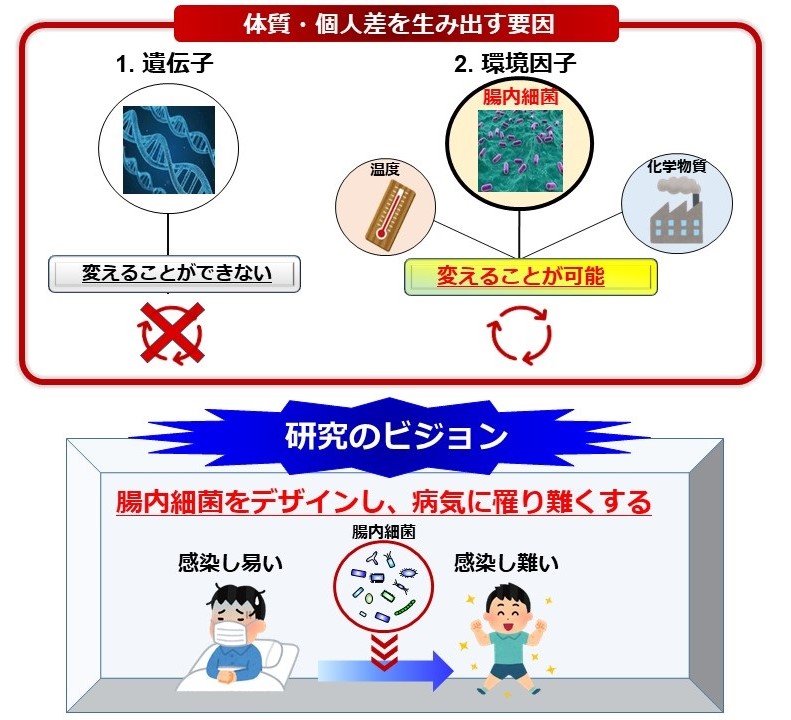
個人差や個体差、体質の違いを決める、最も大きな要因はその人が持つ遺伝子です。でも、遺伝子のみで話が完結する訳ではありません。例えば、住む場所や食べ物、運動などの生活習慣が変わると、感染し易くなる(もしくは、感染し難くなる)ことは、多くの人が経験しています。つまり、感染し易さ、感染し難さは、遺伝子だけでなく環境や生活習慣によっても大きな影響を受けています。
私達の研究室では、環境因子のなかでも特に腸内細菌に着目しています。なぜ、腸内細菌なのでしょうか?一般的に環境因子(食べ物、気温、光など)の大きな特徴として影響が一過性であることが挙げられます。一方、腸内細菌は24時間365日、生まれてから死ぬまで私達の腸の中に生息(共生)しています。そのため、腸内細菌は環境因子でありながら、私達の体に組み込まれている遺伝子と同じく、生まれてから死ぬまで絶え間なく私達に影響を与えているのです(下図)。この影響は非常にとても大きく、特に私達の免疫システムに多大な影響を及ぼしています。近年の研究から感染症、代謝疾患、炎症性腸疾患、がん、アレルギー、精神・神経疾患、皮膚疾患、免疫疾患など、実に様々な病気との関係が指摘されています。そのため、私達が健康を保つ上で、腸内細菌の存在は極めて重要であり、魅力的な研究対象なのです。
私達の研究のビジョン
私達が腸内細菌に注目するもう一つの理由は、腸内細菌は変えることができるということです。遺伝子は、残念ながら生まれた後に変えることはできません。一方で、食べ物を変えたり、乳酸菌(プロバイオティクス)飲料を飲んだり、腸内細菌製剤を服用したりすることで、腸内細菌を変えることが可能です(下図)。そのため、腸内細菌を変えてあげることで、私達の様々な体質も変えることが可能ではないでしょうか?このような発想の下、私達は「腸内細菌を最適化(デザイン)することで、病気に罹り難くする(例:感染し易い人の腸内細菌を変えてあげることで、感染し難い体を手に入れる)」というビジョンを設定して、日々、研究に取り組んでいます(下図)。
未来を創るための研究のミッション
このビジョンを実現するために、私達は現在、1. 病気(例:感染症)に対して良い効果がある腸内細菌を同定・分離し、腸内細菌を用いて病気の予防・治療戦略を確立する、2. 病気に対する腸内細菌の予防・治療効果の機序を解明する、3. 腸内細菌の共生(常在化)機構を理解し、腸内細菌を最適化(デザイン)する技術を確立する、という3つのミッションを設定しています(下図)。これらのミッションを達成することで、将来的に皆が腸内細菌を最適化し、病気に罹り難い体を手に入れられる世の中を目指します。世界中の人が、毎日うがい、手洗いするのと同じように、自分に合った腸内細菌製剤やプロバイオティクスを服用して腸内細菌を整える、このような未来を私達と一緒に創っていきませんか?(下図)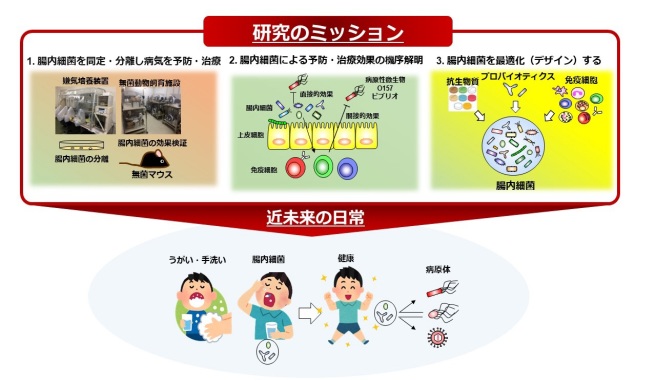
当研究室では、嫌気培養装置や無菌マウス飼育施設を用いて、細菌(例:腸管出血性大腸菌O157、ビブリオ)・真菌(Candida albicans)・ウイルス(インフルエンザ)感染症に対して、感染防御効果をもつ腸内細菌の同定・分離を進めています。さらに、分離した腸内細菌や腸内細菌由来代謝産物を服用することで、感染症の予防・治療を図る技術の開発を進めています。
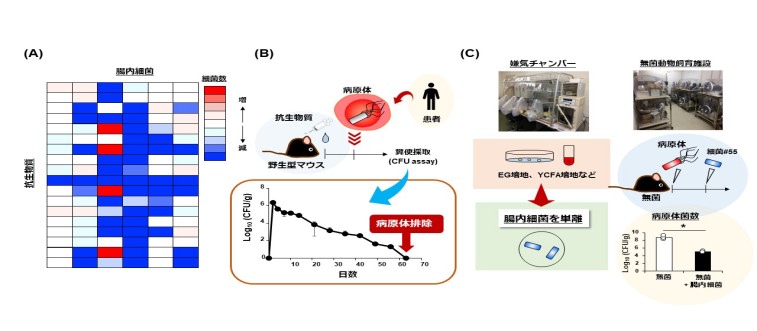
2. 腸内細菌による病気の予防・治療効果の機序を解明する
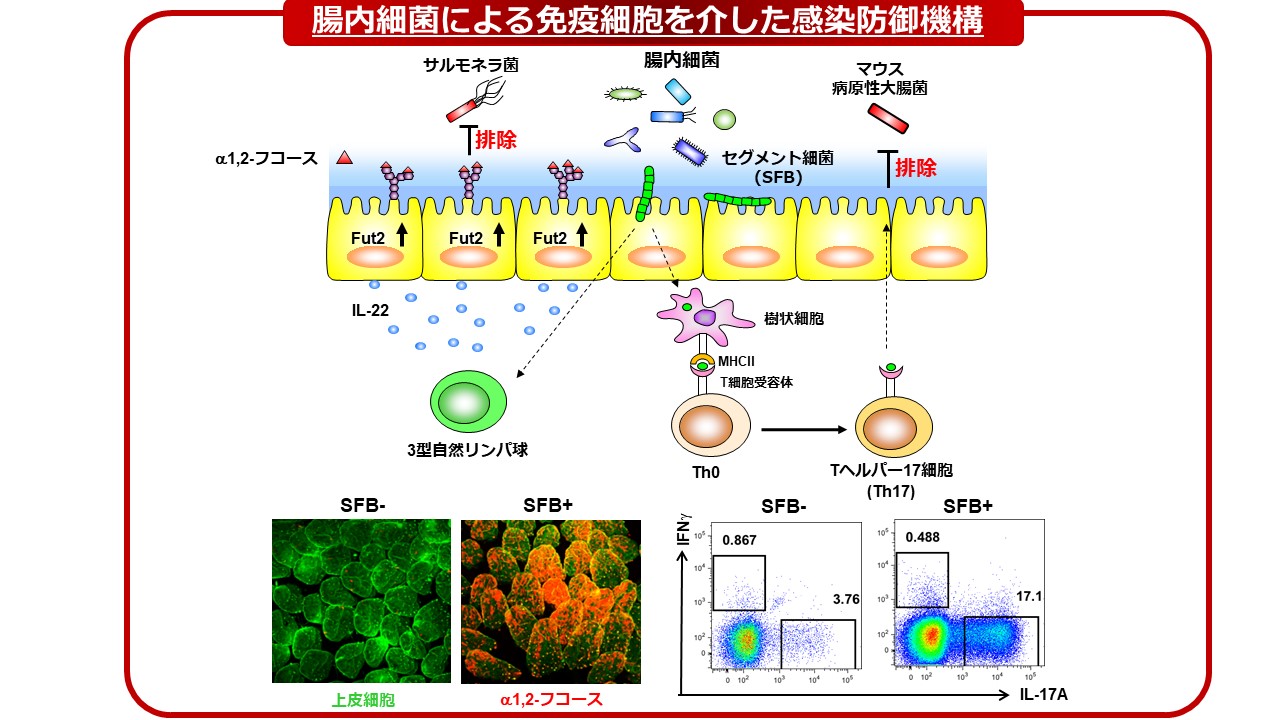
細菌・真菌・ウイルス感染症に対して防御効果がある腸内細菌を用い、感染防御機序を分子・細胞・個体レベルで明らかにします。感染防御機序は、大きく分けて2つ(直接的機序と間接的機序)があります。直接的機序では、メタゲノム解析やメタボローム解析を通じて腸内細菌が産生する代謝産物を理解し、感染防御に寄与する遺伝子・代謝産物の同定と、代謝産物による殺菌や増殖抑制機序の解明を進めています。間接的機序では、腸内細菌による宿主上皮・免疫細胞の活性化を通して、微生物の感染を防御する機序の解明を行っています。私達は主に、Tヘルパー17(TH17)細胞や3型自然リンパ球、IgA陽性細胞に着目し、腸内細菌との相互作用や疾患発症・制御機序に関わる研究を展開しています(下図)。
3. 腸内細菌の共生(常在化)機構を理解し、腸内細菌を最適化(デザイン)する技術を確立する
腸内細菌を人為的に制御する技術を開発するために、栄養素や抗生物質がどのように腸内細菌に影響を及ぼすか調べています。また、特定の腸内細菌を服用した時や、宿主の免疫細胞・免疫因子を欠損したマウスの腸内細菌を確認することで、特定の腸内細菌や免疫細胞が腸内細菌全体に与える影響も調べています。また、CRISPR/Cas9システムを使い、特定の腸内細菌や遺伝子を除去する戦略や、特定の細菌の動態を追跡する技術開発も進めています。
(文責 後藤義幸 2023年11月25日)






