
<研究内容>
真菌医学研究センターでは、平成22年度から新たにPI (Principal Investigator) プロジェクト制で研究活動を行っています。
現在当分野で行われているプロジェクトは以下の2つです。両プロジェクトは、分野内で連携をとりながら共同で研究を進めています。それぞれの研究内容の詳細は以下をクリックしてください。
感染応答プロジェクト (PI: 米山)
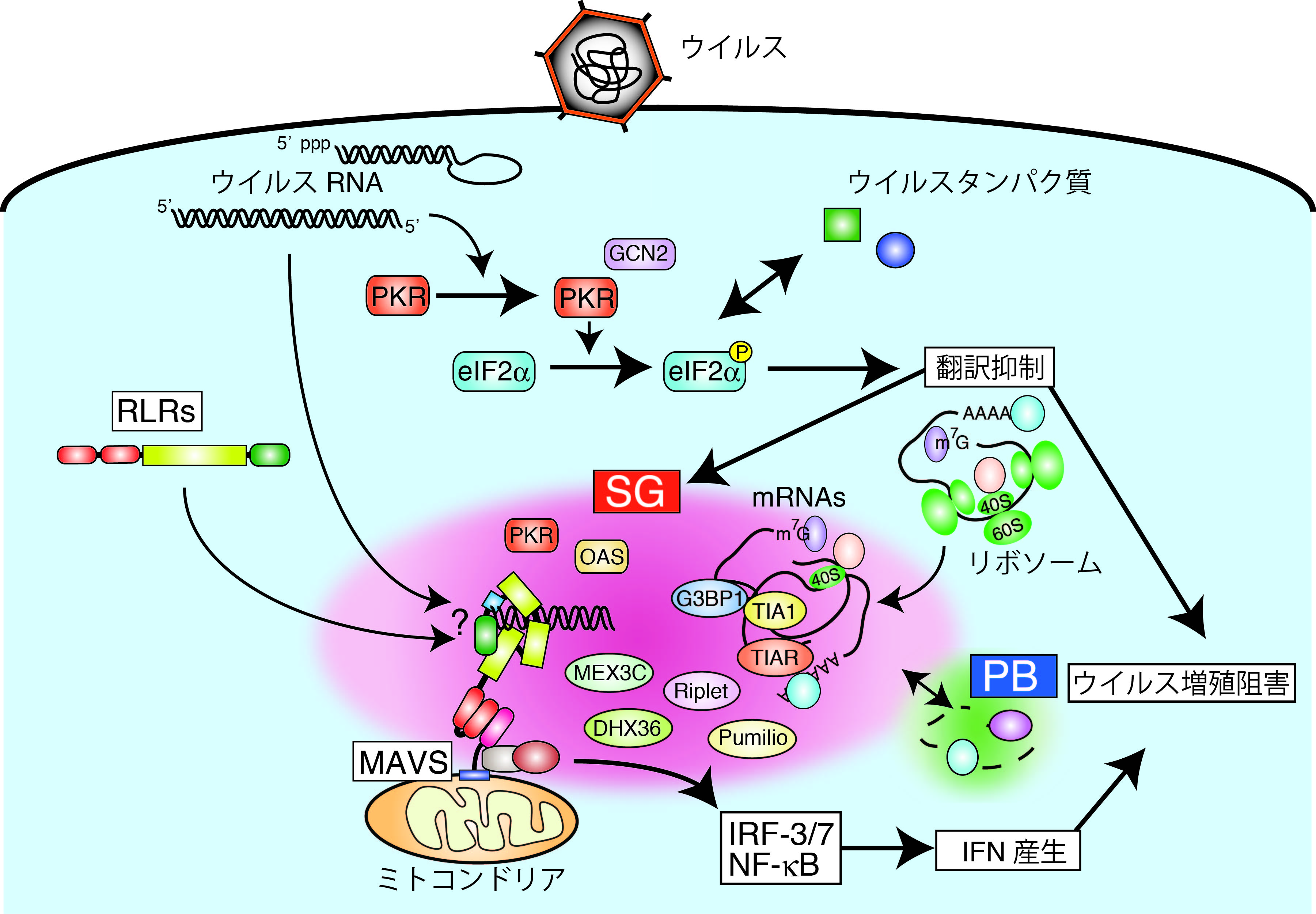
インフルエンザ、ウイルス性肝炎、AIDSなど、ウイルス感染症は今なお大きな社会問題になっています。我々の身体は、自然免疫と獲得免疫という2つの免疫システムを協調的に働かせることによって、これらのウイルス感染症に対抗しています。なかでも自然免疫は、我々の細胞が持っている種々の感染センサー分子によって病原体が特異的に検知されることにより速やかに誘導され、感染初期のウイルス排除の必須な役割を担っていることが知られています。またこの自然免疫は、その後に誘導される獲得免疫の制御にも関与していることから、自然免疫誘導の分子機構とその生理機能を明らかにすることは、ウイルス感染症対策を考えるうえで非常に重要なテーマであると考えられます。本プロジェクトでは、我々が同定したウイルスセンサーであるRIG-I-like receptor (RLR)に注目し、その機能制御とシグナル伝達機構の解析を通じて、将来的に新しい抗ウイルス治療戦略の開発へとつながる知見を得ることを目指した研究を行っています。
これまでの解析から、以下のようなことが明らかになっています。
- RLRは細胞内ウイルスセンサーとして、自然免疫誘導、特に抗ウイルスサイトカインであるI型インターフェロン(IFN)遺伝子の発現誘導に必須な役割を担っている。
- 3種のRLR(RIG-I, MDA5, LGP2)のうち、RIG-IとMDA5は異なる構造のウイルス由来RNAを特異的に認識する。
- 細胞内でウイルス由来の非自己RNAを認識したRIG-I/MDA5は、ATP依存的な構造変化によって活性型に構造変化し、下流のアダプター分子IPS-1と会合することでシグナルを伝達する。
- ウイルス感染により誘導されるストレス顆粒(Stress granule: SG)が、RLRによる感染検知に重要な役割を担っている。
本プロジェクトでは、これまでの解析をさらに進め、RLRがどのように非自己RNAを認識してシグナルを活性化するのか?、ウイルス検知にSGがどのように関与しているのか?、などのテーマについて分子生物学、生化学、細胞生物学的な手法を用いて明らかにすることを目指しています。それによって得られる知見は、RLRを標的にした新しい抗ウイルス薬の開発へつながる可能性があります。
またRLRは、自己と非自己RNAを識別してその生理機能を発揮すると考えられていますが、様々な内在性RNA(自己RNA)とRLRとの関係については明らかになっていません。この内在性RNAとRLRとの関係を解析することで、RLRの生理機能をさらに理解することを目指しています。一方で、RLRの機能と免疫性疾患との関係も明らかではありません。RLRが自己免疫疾患や抗腫瘍免疫に関与する可能性についても、マウスモデルを用いて検討してゆきたいと考えています。
サイトカインプロジェクト (PI: 西城)
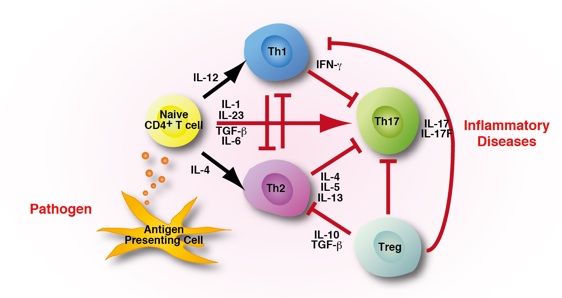
サイトカインは、ほ乳動物の細胞から分泌され、そばにいる細胞の表面に発現している受容体を介して機能を発揮します。サイトカインの種類や機能は多岐に渡り、細胞増殖や分化に関与しているもの、細胞の活性化、あるいは抑制に関与しているものなどが知られています。微生物などの外来異物から自己を守るためには必須の分子ですが、過剰な反応は炎症性疾患を引き起こす可能性があり、その産生は厳密に制御されています。しかし、時としてその制御機構が破綻することもあり、自己免疫疾患やアレルギー疾患等の原因となっています。本プロジェクトでは、サイトカインを中心に、免疫系恒常性の維持機構と破綻のメカニズムを解明し、最終的に感染性疾患や炎症性疾患の治療薬の開発につながることを見据え、研究を行っています。
これまでの研究から、以下のことが明らかになっています。
- 糖鎖を認識する受容体(C型レクチン)であるDectin-1はβグルカンを認識し、IL-6、TNFなどの炎症性サイトカインや活性酸素種(ROS)の産生を誘導する。
- 別のC型レクチンであるDectin-2はαマンナンを認識し、IL-1、IL-6、TNFなどの炎症性サイトカインの産生を誘導し、この時誘導されたサイトカインはnaïve T細胞をIL-17産生性T細胞であるTh17に分化させる。
- Dectin-1欠損マウスはカリニ感染に対して易感染性になり、Dectin-2はカンジダ感染に対して易感染性になる。従って、Dectin-1はカリニ感染防御に対して、Dectin-2はカンジダ感染防御に対して重要な役割を担っている。
- IL-17欠損マウスはカンジダ感染に対して易感染性になり、感染後の生存率が低下するが、関節炎の発症には抵抗性になる。この結果は、IL-17は真菌感染防御に重要な役割を担っている一方で、自己免疫性関節炎の発症の原因にもなっていることを示す。
本プロジェクトでは、遺伝子欠損マウスやトランスジェニックマウスなどを用いた個体レベルでの研究を行っています。免疫疾患などの様に、細胞間、組織間でのネットワークを介した高次の生命現象を解析するためには、遺伝子改変動物はとても有効で、なくてはならないツールです。今後も炎症反応とその結果おこる病気について、個体レベルで研究を続けて行きたいと思います。

