研究内容
感染応答プロジェクト
COVID-19、インフルエンザ、ウイルス性肝炎、AIDSなど、ウイルス感染症は今なお大きな社会問題になっています。我々の身体は、自然免疫と獲得免疫という2つの免疫システムを協調的に働かせることによって、これらのウイルス感染症に対抗しています。なかでも自然免疫は、我々の細胞が持っている種々の感染センサー分子によって病原体が特異的に検知されることにより速やかに誘導され、感染初期のウイルス排除の必須な役割を担っていることが知られています。またこの自然免疫は、その後に誘導される獲得免疫の制御にも関与していることから、自然免疫誘導の分子機構とその生理機能を明らかにすることは、ウイルス感染症対策を考えるうえで非常に重要なテーマであると考えられます。本プロジェクトでは、我々が同定したウイルスセンサーであるRIG-I-like receptor (RLR)に注目し、その機能制御とシグナル伝達機構の解析を通じて、将来的に新しい抗ウイルス治療戦略の開発へとつながる知見を得ることを目指した研究を行っています。
プロジェクトの内容
これまでの解析から、以下のようなことが明らかになっています。
- RLRは細胞内ウイルスセンサーとして、自然免疫誘導、特に抗ウイルスサイトカインであるI型インターフェロン(IFN)遺伝子の発現誘導に必須な役割を担っている。
- 3種のRLR(RIG-I, MDA5, LGP2)のうち、RIG-IとMDA5は異なる構造のウイルス由来RNAを特異的に認識する。
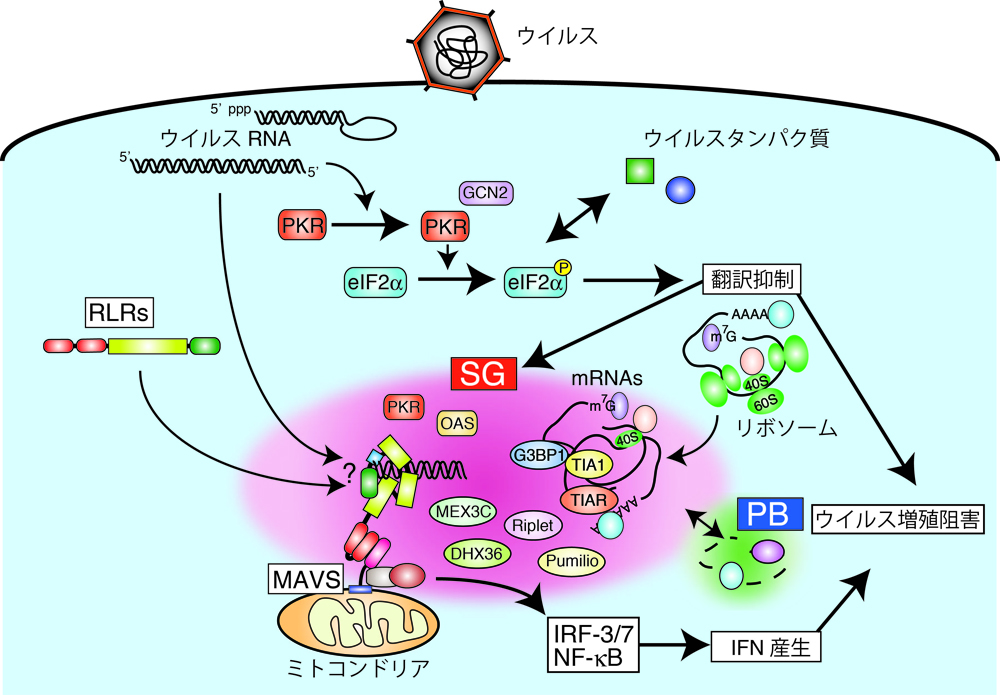
- 細胞内でウイルス由来の非自己RNAを認識したRIG-I/MDA5は、ATP依存的な構造変化によって活性型に構造変化し、下流のアダプター分子IPS-1/MAVSと会合することでシグナルを伝達する。
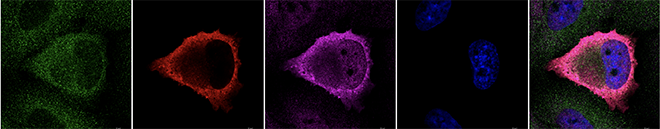
- ウイルス感染により誘導されるストレス顆粒(Stress granule: SG)が、RLRによる感染検知に重要な役割を担っている。
(1) ストレス顆粒形成と抗ウイルス活性
ウイルス検知にストレス顆粒(SG)がどのように関与しているのか?について、分子生物学、生化学、細胞生物学的な手法を用いて明らかにすることを目指しています。SGとは、様々なストレスに応答して細胞質に形成され、主にメッセンジャーRNAとそこに結合するRNA結合タンパク質(RBP)からなる凝集体です。これまでの解析から、ウイルス感染に応答してRLRがウイルスRNAと共にSGへ局在し、I型IFN誘導の増強に関与することを明らかにしてきました。現在は、そこに関わる宿主RBPの機能解析を通じて、どのようにSGがRLRを介したI型IFN誘導に間よするかを解析しています。それによって得られる知見は、RLRを標的にした新しい抗ウイルス薬の開発へつながる可能性があります。
(2) ストレス応答と抗ウイルス活性
ウイルス感染は、細胞にとって大きなストレスです。ウイルス感染に応答して、小胞体ストレスなど様々なストレス応答が誘導されることがわかってきています。細胞ストレス応答が、抗ウイルス自然免疫にどのように関与しているのかについて解析しています。
(3) RLRによるRNA識別と生理機能
RLRによる自己と非自己のRNA識別、特に多用な内在性RNA(自己RNA)とRLRとの関係についてはまだ明らかになっていない点があります。この内在性RNAとRLRとの関係を解析することで、RLRの生理機能をさらに理解することを目指しています。また、RLRの機能の異常は、自己応答性の疾患と関係することが明らかになっています。RLRの制御機構をマウスモデルを用いて検討することで、様々な疾患に関与する可能性についても検討したいと考えています。
(4) SARS-CoV-2感染によるIFN誘導阻害の分子機構
新型コロナウイルス感染症(COVID-19)では、感染初期のIFN誘導の抑制が疾患の重症化に関与する可能性が示唆されています。SARS-CoV-2ウイルス感染に応答したIFN誘導におけるRLRの関与やウイルス因子によるRLR経路の阻害機構などの解析から、COVID-19や次のウイルスパンデミックに対応可能な治療標的を見い出すことを目指した解析を行っています。